干细胞临床研究政策:在创新与安全之间寻找平衡点
干细胞技术被誉为再生医学的“希望之星”,为无数难治性疾病带来了曙光。然而,这片充满潜力的科学前沿也伴随着复杂的伦理挑战和潜在风险。因此,干细胞临床研究政策的制定与完善,不仅是科学议题,更是一项关乎安全、伦理与公众信任的社会工程。它旨在构建一个既能推动科技创新,又能确保患者权益与安全的监管框架。
政策的核心目标:安全与伦理双底线
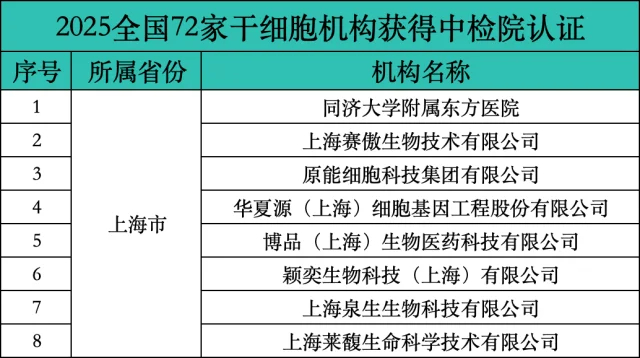
全球各国的干细胞临床研究政策虽各有侧重,但核心目标高度一致:严格监管,保障安全,明确伦理边界。政策的首要任务是确保研究过程的安全性与可控性。这通常体现在对研究机构、研究人员以及研究方案的严格资质要求上。例如,在中国,能够开展干细胞临床研究的必须是具有三级甲等资质的医院,并配备相应的临床研究质量管理体系。这种高门槛的设置,正是为了从源头上把控研究质量。
伦理审查是政策中不可或缺的一环。任何涉及人体的干细胞临床研究都必须经过独立的伦理委员会的严格审查。委员会需要评估研究的科学价值是否大于风险,知情同意过程是否充分、透明,以及是否采取了有效措施保护受试者的隐私和权益。《赫尔辛基宣言》 等国际伦理准则在其中发挥着重要的指导作用。
关键环节:从备案审批到全过程监管
一个健全的干细胞临床研究政策体系,必然覆盖从起始到结束的全过程。
备案与审批制度:研究项目在启动前,必须向国家药品监督管理部门(如中国的国家药品监督管理局/NMPA)进行备案或申请审批。这一环节是对研究方案科学性、可行性和安全性的集中把关。政策明确规定了需要提交的材料清单,包括细胞来源、制备工艺、质量控制、临床前研究数据等,确保研究的每一个环节都有据可查。
禁止临床滥用:一项至关重要的政策红线是严禁将尚处于研究阶段的干细胞技术直接作为临床应用向患者收费。这明确区分了“临床研究”与“成熟疗法”。研究的目的在于验证安全性和有效性,参与者应是自愿且免费的。这一规定有效遏制了市场上打着“干细胞疗法”旗号误导消费者、牟取暴利的乱象。
长期随访与监督:干细胞治疗可能存在长期效应和潜在风险,因此政策要求研究者必须对受试者进行长期随访,密切监测任何不良反应,并及时向监管部门报告。这种动态监管机制确保了即使在研究开展后,风险依然处于持续监控之下。
案例分析:政策引导下的规范发展
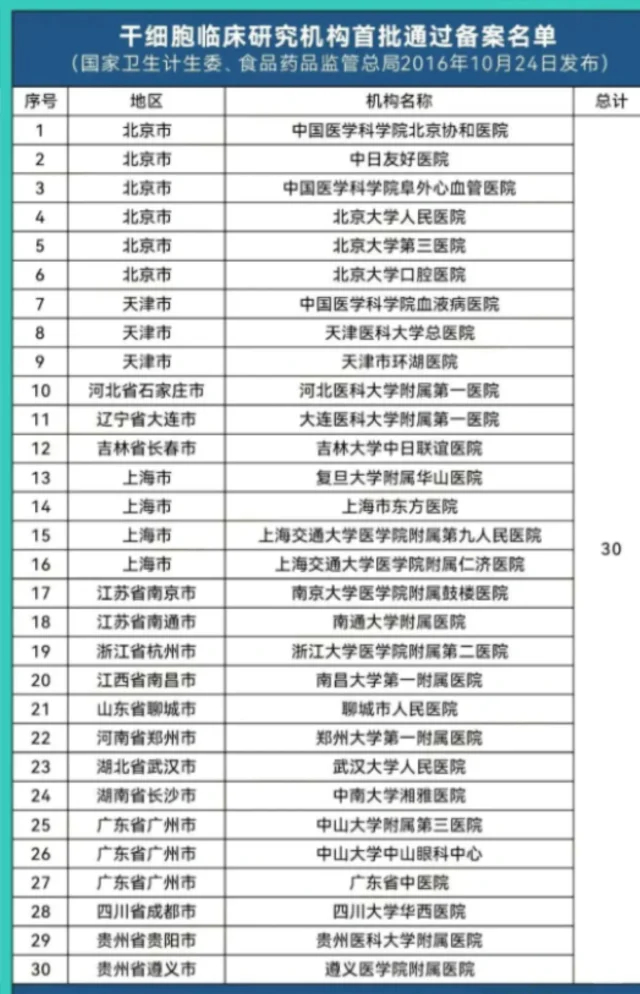
以我国为例,近年来出台的《干细胞临床研究管理办法(试行)》等一系列政策,为行业树立了清晰的规则。这些政策不仅明确了“双备案”机制(机构备案与项目备案),还强调了干细胞制剂的质量检定的重要性。在实践中,一些知名的三甲医院在政策框架内,针对如卵巢早衰、帕金森病等疾病开展的干细胞临床研究,都严格遵守了上述流程。这些研究在招募受试者时,会进行极其严格的评估和充分的知情同意,所有治疗相关费用均由研究项目承担,完美诠释了政策所倡导的“研究归研究,治疗归治疗”原则,为干细胞技术的健康发展树立了典范。
总而言之,干细胞临床研究政策并非创新的“绊脚石”,而是行业可持续发展的“护航员”。随着科学认知的不断深入,相关政策也必然是一个动态演进、不断完善的过程。只有在严谨政策的引导下,干细胞的巨大潜力才能真正安全、负责任地转化为惠及全人类的医学成果。