好的,这是一篇根据您的要求生成的关于“干细胞行业监管政策”的SEO文章。
干细胞行业监管政策:在创新与安全的钢丝上行走
前言
在21世纪的医疗前沿,干细胞技术犹如一颗璀璨的明星,承载着治愈帕金森病、糖尿病、脊髓损伤等重大难疾的无限希望。然而,这份巨大的潜力也伴随着伦理的挑战和潜在的风险。如何在鼓励科技创新与保障患者安全之间找到平衡点?答案的核心,便在于一套科学、严谨且动态发展的监管政策体系。这篇文章将深入探讨全球及中国干细胞行业的监管框架,解析其如何为这一新兴行业保驾护航。
一、监管的必要性:为何“紧箍咒”不可或缺?
干细胞,尤其是具有多向分化潜能的干细胞,其临床应用远非简单的药物或器械可比。其独特性决定了监管的极端重要性。
- 安全性风险:干细胞在体外的增殖、分化过程若控制不当,可能导致肿瘤形成(如畸胎瘤)、免疫排斥反应或非预期分化等严重不良反应。
- 有效性验证:许多干细胞疗法仍处于临床研究阶段,其长期疗效和稳定性需要经过严格的临床试验来证实,避免给患者带来“虚假的希望”和经济损失。
- 伦理道德红线:涉及人类胚胎干细胞的研究与应用,始终绕不开生命起源的伦理争议,必须设定明确的伦理边界,防止技术滥用。
因此,监管政策并非创新的“绊脚石”,而是行业健康发展的“奠基石”。它旨在去伪存真,将扎实的科学研究与商业炒作区分开来。
二、全球监管格局:以美国、欧盟为镜
纵观全球,主要医药强国对干细胞产品的监管普遍倾向于将其视为 “药品” 进行管理。
- 美国FDA:采用“风险分级”管理模式。绝大多数用于治疗疾病的干细胞产品被归为生物制品,必须遵循与药品同样严格的临床前研究、新药临床试验申请(IND)和上市审批(BLA)流程。这确保了产品在质量、安全性和有效性上达到统一标准。
- 欧盟EMA:同样将先进的干细胞疗法归类为先进治疗医学产品(ATMPs),并建立了集中式的审批程序。这使得一旦获批,产品便可在整个欧盟市场流通。
这种“药品化”监管模式的核心思想是:任何医疗干预,无论其技术多么前沿,都必须以确凿的科学证据为基础。
三、中国监管的演进与现状:从混乱走向规范
中国的干细胞行业曾经历过一段无序发展的时期,部分机构打着“干细胞美容”、“干细胞抗衰老”的旗号进行不规范收费治疗。为此,国家卫健委、国家药监局等监管部门近年来大力整顿,逐步建立起清晰的监管框架。
目前,中国的监管思路与国际主流接轨,主要体现在:
“双轨制”监管:干细胞相关活动被明确划分为临床研究和临床应用两个阶段。
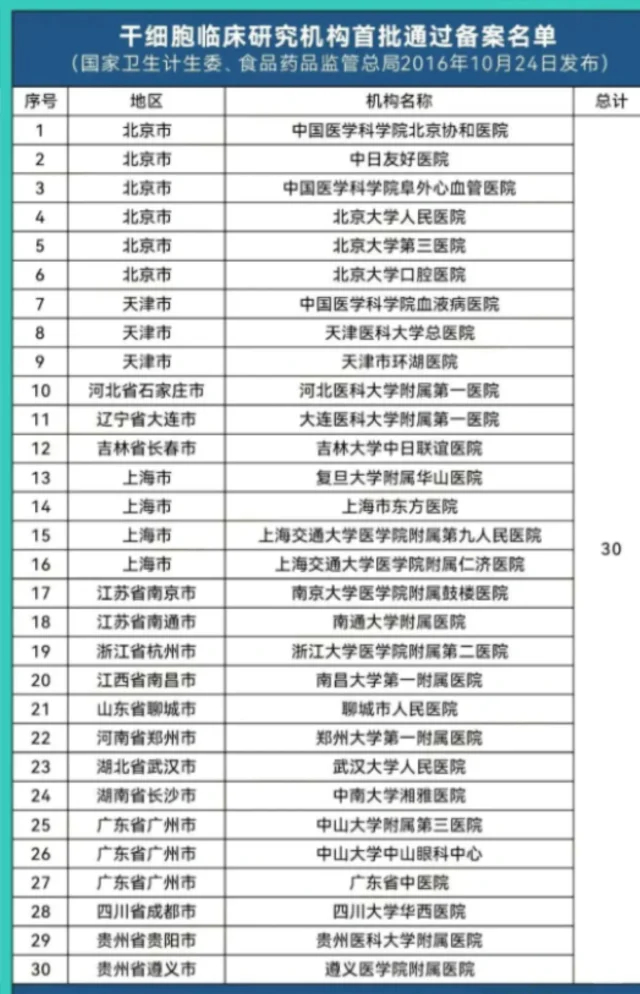
- 临床研究阶段:由卫健委和药监局共同监管,研究机构必须在国家备案系统中完成项目备案,并严格遵守伦理审查和技术规范。
- 临床应用阶段:干细胞制剂被明确按药品管理。这意味着,任何希望上市的干细胞产品,都必须向国家药监局(NMPA)提交申请,获得药品批准文号后方可用于临床治疗。
强化过程监管:政策强调对干细胞从采集、运输、制备到检验的全过程进行质量管理,确保细胞的可追溯性和质量的均一性。
案例分析:近年来,国内多家企业的干细胞新药临床试验申请(IND)获得批准,适应症包括膝骨关节炎、移植物抗宿主病等。这标志着中国的干细胞产业正在监管的指引下,逐步走上以临床价值为导向的规范化研发道路。
结语:未来展望
《干细胞临床研究管理办法》、《细胞治疗产品研究与评价技术指导原则》 等关键政策的出台,为行业划定了清晰的跑道。对于企业和科研机构而言,深入理解并严格遵守这些政策,是参与竞争的前提。未来,随着类器官、基因编辑等新技术的融合,监管政策也需保持动态更新,在坚守安全底线的同时,为真正的创新疗法开辟“绿色通道”。
关键词:干细胞行业监管政策、干细胞临床研究、细胞治疗产品、药品化管理、国家药监局(NMPA)、伦理审查、临床试验。