好的,这是一篇根据您的要求生成的SEO文章。
干细胞治疗药品监管政策解读:在创新与安全之间寻求平衡
前言
随着再生医学的飞速发展,干细胞治疗作为一颗璀璨的明星,为众多难治性疾病带来了希望的曙光。然而,这片充满潜力的“蓝海”也伴随着巨大的不确定性。如何确保这类前沿疗法的安全性与有效性,同时又不扼杀其创新活力?答案的核心,便在于科学、严谨的监管政策。本文将深入解读我国干细胞治疗的监管框架,帮助您清晰理解这一领域的“游戏规则”。
一、从“医疗技术”到“药品”:监管范式的根本性转变
在过去一段时间,干细胞治疗常被归类为“第三类医疗技术”进行管理。这种模式存在一定的模糊地带,导致市场出现了一些不规范的行为。为了与国际接轨并建立更严格的监管体系,国家药品监督管理局(N药监)明确了将干细胞治疗产品按照药品管理的基本原则。
这一转变意味着,任何用于治疗的干细胞产品,都必须像传统化学药、生物药一样,经过严格的非临床研究、临床试验审评审批,在证明其安全、有效、质量可控后,才能最终获批上市,用于临床治疗。这从根本上确立了干细胞产品的“药品”属性,为整个行业的健康发展奠定了基石。
二、核心监管框架与关键要求
目前,我国对干细胞治疗产品的监管主要遵循《药品管理法》和《药品注册管理办法》等法规,并辅以一系列具体的技术指导原则。
《细胞治疗产品研究与评价技术指导原则》:这份文件是行业发展的纲领性文件。它强调,风险控制是核心,产品质量是关键。从细胞的供者筛查、采集、运输,到生产过程的质控、成品检验,再到临床试验的全过程,都必须建立一套完整的、可追溯的质量管理体系。
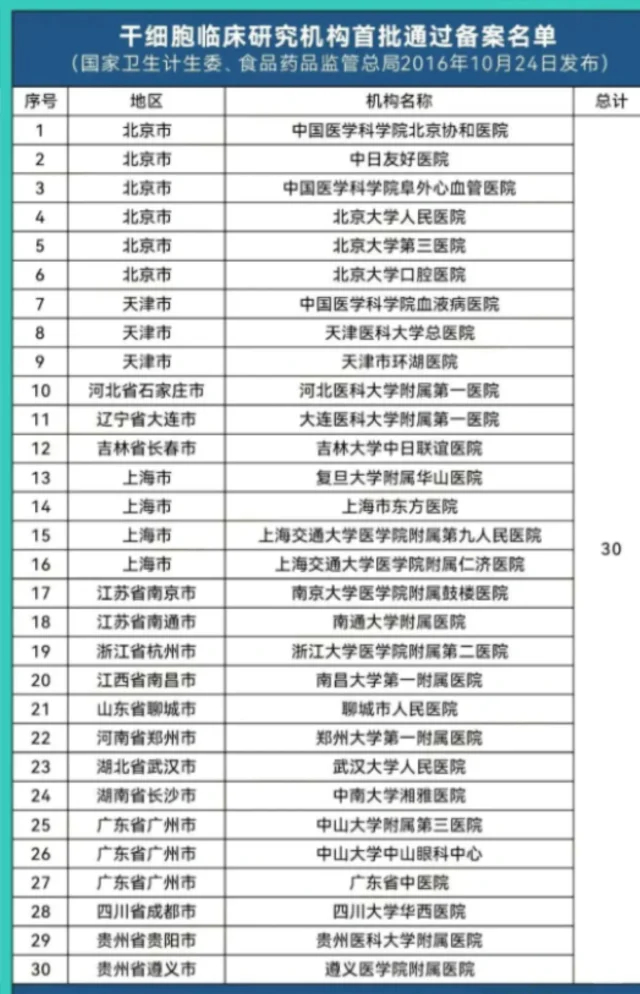
临床试验备案制:干细胞临床研究实行备案管理。开展研究的机构必须是三级甲等医院,具备较强的医疗、科研和伦理审查能力。研究项目必须通过机构的伦理委员会审查,并在国家卫健委和药监局的电子平台上完成双备案。这一机制既赋予了科研机构一定的灵活性,又确保了研究在监管的视野内有序进行。
“双轨制”监管:目前存在一个重要的“双轨制”概念。一方面,作为“药品”的干细胞产品由药监局监管,目标是最终获批上市。另一方面,允许符合条件的医疗机构开展干细胞临床研究,这部分由卫健委和药监局共同监管,但其目的仅限于科研,不能向患者收费。严格区分“临床研究”与“商业化治疗”,是保护受试者权益、打击非法诊疗的关键。
案例分析:监管趋严下的行业规范
近年来,监管部门对多家涉嫌违规开展干细胞治疗、夸大宣传的机构进行了查处和曝光。这些行动清晰地传递出一个信号:任何未经药品审评审批、直接向患者收费的干细胞注射治疗都是不合规的,存在巨大安全隐患。这些案例也促使真正有志于创新的企业将资源聚焦于扎实的临床前研究和规范的临床试验上,推动了行业的“良币驱逐劣币”。
三、展望未来:挑战与机遇并存
干细胞治疗药品的监管之路仍面临挑战,例如针对其“活”的特性,如何制定更精准的质量标准;如何加速针对严重疾病、有突出疗效产品的审评速度等。
然而,清晰的监管政策是行业发展的“稳定器”和“催化剂”。它为投资者带来了明确的预期,为研发者指明了方向,最终是为每一位患者筑起了安全的防线。随着政策体系的不断完善和科学认知的持续深化,我们有理由相信,干细胞治疗这一前沿科技将在规范的轨道上,更好地造福人类健康。